从“中国创新”到“全球价值”,复宏汉霖(2696.HK)H药拿下欧洲上市批文
新年伊始,医药行业捷报频传。作为国内首批从biotech成功转型为更具规模化和市场竞争力的biopharma企业,复宏汉霖在国际化进程中再传佳音。
根据公司公告显示,2月2日,复宏汉霖自主研发的自主研发的帕妥珠单抗生物类似药HLX11美国上市许可申请获美国食品药品监督管理局(FDA)受理。这是复宏汉霖第3款在美国申报上市的自研产品。
2月5日,复宏汉霖自主研发的抗PD-1单抗H药——汉斯状®(斯鲁利单抗,欧洲商品名:Hetronifly®)正式获得欧盟委员会(European Commission, EC)批准,联合卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)成人患者的一线治疗,成为全球首个且唯一在欧盟获批用于广泛期小细胞肺癌治疗的抗PD-1单抗。
2月6日,复宏汉霖发布公告,公司与印度制药巨头瑞迪博士实验室达成在研生物类似药HLX15欧美市场授权。据悉,该产品在2024年宣布完成临床I期试验,目前,HLX15的疗效比对研究正在推进中。这项授权交易将为复宏汉霖带来超过3300万美元首付款,交易总金额超过1.3亿美元。
开年一连发布三条欧美市场进展,海外布局动作频频。根据WIND数据显示,复宏汉霖在新年开门红的一系列利好推动下,股价近9个交易日累计上涨近20%,成功站上20港元大关(数据截至2月7日收盘)。这一表现不仅反映了市场对公司国际化战略的认可,也彰显了投资者对H药商业化前景的信心。
从“中国创新”走向“全球价值”,复宏汉霖是如何做到的?
图表一:复宏汉霖近期股价表现
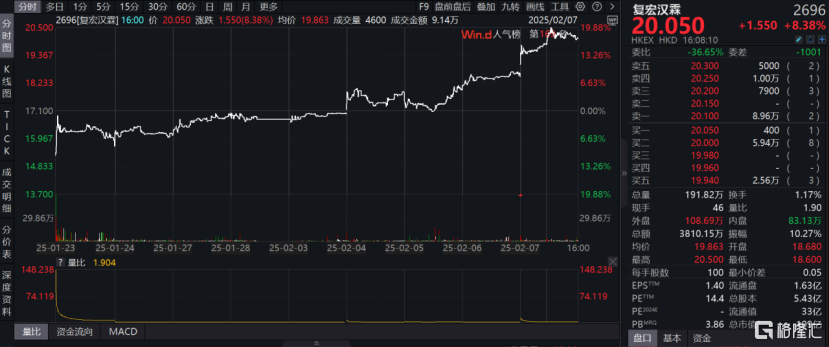
数据来源:WIND,格隆汇整理 数据截至2025年2月7日收盘
再下一城!H药拿下欧洲上市批文
H药在欧洲的成功获批,无疑标志着复宏汉霖全球化战略征程中的一座重要里程碑。
作为全球首个且迄今唯一一款在欧洲获得批准,用于一线治疗广泛期小细胞肺癌(ES-SCLC)的PD-1单抗,H药凭借其显著的差异化优势脱颖而出。小细胞肺癌(SCLC),尤其是其广泛期形式,历来是医疗领域的一大挑战,因长期缺乏高效的治疗方案而令患者深感绝望。H药的获批上市,犹如一束光芒,为这一重病患者群体照亮了新的希望之路。
从市场潜力的角度审视,H药的这一里程碑式成就不仅填补了欧洲市场在治疗ES-SCLC领域的空白,更为复宏汉霖在全球范围内的商业化布局注入了强劲动力,为其未来的成长开辟了广阔的空间。
根据IQVIA的数据预测,至2030年,欧洲的PD-(L)1市场规模有望突破280亿美元大关。SCLC患者的占肺癌总数的15%-20%,具有恶性程度高、转移早、疾病进展迅速等特点,预后极差。作为首个也是唯一在欧盟获批用于治疗ES-SCLC的PD-1单抗,H药的上市无疑将迅速抢占市场份额,有望成长为复宏汉霖海外收入的重要支柱之一。
值得一提的是,2022年12月,H药治疗SCLC获得EC授予的孤儿药资格认定,有助于H药用于治疗SCLC在欧盟研发、注册及商业化等方面享受一定的政策支持。欧盟《孤儿药法规》确立了孤儿药资格认定的集中审批程序,并为孤儿药的研发和上市制定了激励措施,包括上市后享有10年市场独占权。
H药在欧洲的获批,仅是复宏汉霖全球化战略宏伟蓝图中的一个精彩片段。
迄今为止,H药已在中国、印度尼西亚、柬埔寨、泰国等超过30个国家成功获批上市。此外,复宏汉霖还通过对外授权的方式,将H药的商业化权益扩展至美国、欧洲、东南亚、中东和北非等70多个国家和地区,构建了一个覆盖广泛的全球化网络。
这一全球化的战略布局,不仅彰显了复宏汉霖在国际市场上的强大竞争力,更为其未来的持续稳健增长奠定了坚实的基础。
复宏汉霖的“野望”:迈向出海全球化2.0时代
近期一系列的出海动作,深刻揭示了复宏汉霖全球化战略已迈入一个崭新的“深度全球化”2.0时代,标志着其在国际医药舞台上的影响力显著提升。
近年来,随着创新药企的蓬勃发展,国际化已成为推动行业前行的关键力量。在这一背景下,复宏汉霖凭借前瞻性的视野和创新的策略,通过License out(对外授权)、成立合资公司(NewCo)等多种方式,积极寻求全球市场的崭新机遇,已然成为引领中国药企国际化的先锋力量。
除了探索更加多元、高效的出海模式,复宏汉霖的国际化征程最亮眼的莫过于成功将产品足迹拓展至全球50多个国家和地区,全面覆盖亚洲、欧洲、美洲和大洋洲,展现出强大的全球布局能力。
汉利康®、汉曲优®、汉斯状®等多款产品的海外市场拓展,不仅创造了多个“首个”或“最多”的行业纪录,更彰显了复宏汉霖的国际化实力。曲妥珠单抗汉曲优®是首个中、美、欧三地获批的生物类似药,成就了主流监管市场的“大满贯”;H药汉斯状®在印尼的成功上市,标志着其正式进军东南亚市场,也是首个登陆东南亚的国产PD-1,同时,其在日本市场的差异化布局以及欧盟获批的预期,进一步巩固了复宏汉霖在全球市场的地位;HLX14地舒单抗已提交欧美新药上市注册申请,HLX11帕妥珠单抗提交中美新药注册申请,更多国家的上市注册申报也在加速推进,更多新产品、新适应症的全球布局均取得突破性进展。
这些成功案例不仅验证了复宏汉霖的国际化能力,更为其构筑了坚实的竞争壁垒。
首先,从全球产能与供应链角度来看,复宏汉霖实现了从“中国制造”到“全球交付”。
基于10余年的出海经验,复宏汉霖已构建了全球化的临床、药政注册和生产的全方位能力。公司建立了徐汇基地、松江基地(一)及松江基地(二)三大生产基地,现有商业化总产能高达48,000升,实现全球产品常态化供应,全面覆盖中国、欧洲、拉丁美洲、中东北非、北美及东南亚等关键市场。同时,公司建立了一套符合国际质量标准的质量管理体系,涵盖从项目研发到物料管理、产品生产、质量控制、产品供应链管理以及产品上市后跟踪的全生命周期。此前,公司商业化生产基地及配套的质量管理体系已通过中国国家药监局、欧洲药品管理局(EMA)、美国食药监局(FDA)、欧盟质量受权人(QP)以及国际商业合作伙伴的实地核查及审计,荣获中国、欧盟和美国GMP认证。
H药在欧盟的获批,不仅是对其临床数据和生产质量体系的国际认可,更为复宏汉霖后续管线(如HLX22、HLX43等)的国际化进程铺平了道路,打开了市场对其创新药“出海溢价”的无限遐想。
其次,复宏汉霖携手具有本地强大商业化网络和资源的海外商业化合作伙伴,加速渗透当地市场,并考虑自建海外商业化团队。
在海外商业化方面,复宏汉霖携手Abbot、Abbott、Accord、Dr. Reddy's、Eurofarma、Kalbe、Organon等跨国药企或当地龙头,高速推进产品在全球市场获批落地,凭借复宏汉霖强大的产品研发及供应能力,以及合作伙伴在当地市场的资源,高效渗透主流监管市场及新兴市场国家,夯实了对终端市场的掌控力。旗下产品已在北美洲、欧洲、拉丁美洲、东南亚、中东北非等区域实现上市销售。
据悉,公司目前也在探索自建海外商业化团队和更加灵活高效的出海模式。
最后,复宏汉霖的创新平台也在加速全球化进程。
公司正在加速开发更多创新产品及潜在first-in-class适应症。同时,通过“国际多中心临床试验”加速管线国际化,如H药针对转移性结直肠癌(mCRC)的III期阶段临床已在日本、印尼等国家同步开展,有望成为全球首个针对不分型mCRC患者的一线免疫疗法。HLX22联合曲妥珠单抗的HER2双靶向疗法的国际多中心III期临床也已完成首例患者入组,有望成为同类疗法中首个用于治疗HER2+胃癌的方案。这种“差异化适应症+国际多中心临床协同”的模式,将显著提升产品竞争格局,缩短创新药在全球市场的上市周期。
小结
2月以来,HLX11(帕妥珠单抗生物类似药)在美国获受理、H药在欧洲的获批、HLX15(达雷妥尤单抗生物类似药)超1.31亿美元授权欧美市场,一系列出海阔步,不仅再次印证了复宏汉霖“生物类似药+生物创新药”双轮驱动发展的战略清醒,更是中国生物药企出海深化的生动写照。
通过“自主研发+全球合作+自主掌控”的三重驱动,复宏汉霖正逐步改写中国药企国际化的叙事篇章,从单纯的产品出口转向技术、产能、品牌的系统性输出。
展望未来,随着海外商业化团队的落地、更多研发管线的推进,复宏汉霖有望成为少数真正具备全球竞争力的中国药企,为投资者带来见证“中国生物药”向“全球价值”跨越的历史性机遇。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管89.42
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管85.36
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中金点国际集团 GD International Group澳大利亚| 1-2年86.64
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照80.52
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.71
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56
- 监管中GO Markets高汇15-20年 | 澳大利亚监管 | 塞浦路斯监管 | 塞舌尔监管87.90
- 监管中alpari艾福瑞5-10年 | 白俄罗斯监管 | 零售外汇牌照87.05
- 监管中AUS Global5-10年 | 塞浦路斯监管 | 澳大利亚监管86.47


